Fysiske og kemiske egenskaber af vand.
I mange århundreder har folk ikke forestillet sigkunne, hvad vand virkelig er, og hvordan det blev dannet på planeten. Indtil 1800-tallet vidste folk ikke, at vand faktisk var et kemisk element. Det blev antaget, at det er et almindeligt kemisk element. For nylig blev det opdaget, at vand er et kemisk element, hvis formel er H2O.
De kemiske egenskaber ved vand afhænger af det fysiskedets atomers art samt måderne at kombinere dem i et molekyle og den efterfølgende gruppering af de dannede molekyler. Da det hele tiden er i kontakt med forskellige stoffer, er vand en opløsning med en meget kompleks sammensætning. Desuden manifesterer sig sig som et fremragende opløsningsmiddel, da det er i stand til at opløse både væsker og faste stoffer og gasser.
Særligt gode er egenskaberne af et sådant opløsningsmiddelmanifesterer sig i havvand, da det kan opløse næsten alle stoffer. Ca. halvfjerds elementer af det periodiske system findes i dets sammensætning. I hav og havvand kan selv sjældne radioaktive elementer detekteres. De mest almindelige stoffer i vandet er chlor, natrium, svovl, kalium, magnesium, calcium, strontium, brom, kulstof og bor.
Til dato har forskeremere komplekse og subtile mekanismer til organisering af vandmassen. Det betragtes som den sværeste forbindelse af alle stoffer, der er kendt for fysikere og kemikere. Den kemiske sammensætning af vand kan ikke være anderledes, men det vil have en anden virkning på den menneskelige krop, da den blev dannet under visse betingelser.
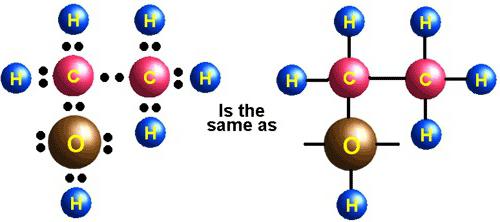
De kemiske egenskaber af vand er også afhængige af detsmolekylær struktur. Især består vandmolekylet af tre atomer, der dannes i form af en isosceles trekant. På toppen er et oxygenatom, mens der ligger i bunden to hydrogenatomer. I dette tilfælde er valensvinklen for NH-bindingen 104,31 °.
Der er også nogle fysiske og kemiskeEgenskaberne for vand, der strider imod principperne i det periodiske bord. Navnlig er de højeste karakteristika for vand dem, der i det væsentlige skal være meget lavere. Dette vedrører frysepunktet og kogepunktet, varmen ved smeltning og fordampning.
Frysning og kogepunkt i hydridElementer i iltundergruppen falder, da forbindelsen lettes. Når der samtidig virker på vandet, ville det koge ved en dyb negativ temperaturværdi ved -70 ° C og at fryse ved -90 ° C. Dette igen, ville provokere mangel på vand på jorden, da det ikke kunne være indeholdt i en flydende eller fast tilstand. Den eneste mulige mulighed er en gasformig tilstand.
Med hensyn til fordampningsvarmen kan siges, at for fordampning af vand opvarmet til 100 ° C, er det nødvendigt at 6 gange mere varme end for et tilsvarende vandmasse opvarmning til 80 ° C.
Med hvert minut af en million tons vand i hydrokfærenfordampes fra solens varme. Som et resultat af en sådan påvirkning indeholder atmosfæren konstant en stor mængde varme, hvilket svarer til, at 40.000 kraftfulde kraftværker ville have været produceret.
Sådanne unikke fysiske og kemiske egenskabervand gør det muligt at bruge det bredt i produktionsaktiviteter. Især i metallurgiske anlæg bruges det meste af vandet til kogende vand til afkøling. En sådan tilsyneladende paradoksal handling forklares ved, at køling opstår på grund af fordampningsvarmen. Samtidig er der ikke behov for at opbygge ekstra køletårne.
Selvfølgelig kan kogende vand som køler kun anvendes på de faciliteter, hvor opvarmningstemperaturen overstiger værdien på 100 ° C.
Unikke fysisk-kemiske egenskaber af vandtillade det at blive brugt i landbruget, og ikke kun for vanding af planter. For eksempel, når der er pludselige frost i slutningen af foråret, der truer blomstrende træer, udfører gartnere den såkaldte sprinkling af haven. En hylde af overfladisk stænk omslutter de frysende træer. Også dråber vand dækker blomsterne selv. Så bliver hun hurtigt til is og dækker sig med blomster og giver dem hendes varme.
Som du kan se, er vandet, hvis kemiske egenskaber endnu ikke er udforsket fuldt ud, en unik blanding, der understøtter alt liv på planeten og er en integreret del af menneskelivet.